山东省枣庄第八中学2015届高三9月阶段性测试化学试题一、选择题(共40分,1-5每题2分,6-15每题3分)
1.白磷在高压下隔绝空气加热后急速冷却,可得深灰色固体——黑磷,其转化过程中能量变化如图所示。下列叙述中正确的是( )

A.黑磷比白磷稳定 B.黑磷与白磷互为同分异构体
C.白磷转化为黑磷是氧化还原反应 D.白磷转化为黑磷是吸热反应
2.串联电路中四个电解池分别装有0.5 mol·L-1的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最小的是( )
A.KNO3溶液 B.NaCl溶液 C.AgNO3溶液 D.CuCl2溶液
3.有关合成氨工业的下列说法中,正确的是( )
A.从合成塔出来的混合气体,NH3的含量较小,所以生产氨的工厂的效率都很低
B.由于氨可液化分离出来,N2、H2在实际生产中循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500 ℃,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是20 MPa~50 MPa,因在该压强下铁触媒的活性最大
4.用惰性电极电解下列物质的溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全相同的是( )
A.CuCl2[CuO] B.NaOH[Na2O] C.NaCl[HCl] D.CuSO4[Cu(OH)2]
5.将0.1 mol·L-1的下列物质的水溶液,从常温加热到90 ℃,溶液的pH几乎不变的是(不考虑水的蒸发)( )
A.氯化钠 B.氢氧化钾 C.硫酸 D.硫酸铵
6.用下列装置能达到预期目的的是( )
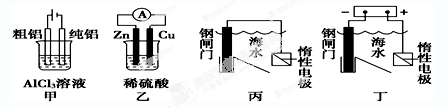
A.甲图装置可用于电解精炼铝 B.乙图装置可得到持续、稳定的电流
C.丙图装置可达到保护钢闸门的目的 D.丁图装置可达到保护钢闸门的目的
7.利用一种新型陶瓷(能传递H+),实现了氨的电化学合成。该过程N2和H2的转化率远高于现在工业上使用的氨合成法。对于电化学合成氨的有关叙述正确的是( )
A.N2在阴极上被氧化 B.可选用铁作为阳极材料
C.阳极的电极反应式是N2+6H++6e-===2NH3
D.该过程的总反应式是N2+3H2 2NH3
8.CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-===2CuI↓+I2而得到。如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI?淀粉溶液中阳极周围变蓝色,则下列说法正确的是( )
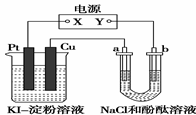
A.若a极变红,则在Pt电极上:2I--2e-===I2,淀粉遇碘变蓝
B.若b极变红,则在Pt电极上:4OH--4e-===2H2O+O2↑,O2将I-氧化为I2,淀粉遇碘变蓝
C.若a极变红,则在Cu电极上:2Cu+4I--4e-===2CuI↓+I2,碘遇淀粉变蓝
D.若b极变红,则在Cu极上:Cu-2e-===Cu2+,Cu2+显蓝色
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的H>0,简述该设想能否实现的依据________________。
(4)III中,将NO2()转化为N2O4(),再制备浓硝酸。
①已知:2NO2() N2O4()△H;当温度升高时,气体颜色变深,则反应为 _____________(填“吸热”或“放热”)反应。
②一定温度下,反应(II)的焓变为△H。现将1molN2O4充入一恒容密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 。
(5)IV中,电解NO制备 NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________, 阴极的电极反应______________________________________, 。
18.(20分)次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为__________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为___________(填化学式)。
③NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显_______(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式_____
______________________________________。
(4)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应____________________________________。
②分析产品室可得到H3PO2的原因___________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有 杂质,该杂质产生的原因是 。
化学答案
(5)(装置图如下) (2分);电极逐渐溶解;(2分) Zn(2分)
17. 【答案】(20分)
(1)4NH3+5O2 4NO+6H2O(2分)
(2)①p1<p2(2分) ②变小 (2分)③<(2分)
(3)①升高温度,平衡正移NO产量增加(2分)。②H>0,S<0 H-TS>0G该反应在任何条件下都不能发生。(2分)
(4)放热(2分),d(2分)
(5)NH3(2分) NO+5e- +6H+=NH4++H2O(2分)
18(20分)
【答案】(1)H3PO2H++H2PO2(2分)-
(2)①+1。(2分)②H3PO4。(2分)③正盐(2分),碱性。(2分)
(3)2P4+3Ba(OH)2+6H2O=2PH3↑+3Ba(H2PO2)2(2分)
(4)①2H2O-4e-=4H++O2↑或4OH--4e-=2H2O+O2. (2分)
②由于阳极室OH-放电,造成H+浓度增大,通过阳膜扩散进入产品室,而原料室中的H2PO2-可以通过阴膜进入产品室,二者反应生成H3PO2. (2分)
③H3PO4或PO43-。(2分)由于H3PO2具有还原性,电解时就会有H3PO2在阳极放电而被氧化生成H3PO4。(2分)