达州市2013年高中阶段教育学校招生统一考试化学试卷
考试时间50分钟,满分75分。
相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 Cl-35.5 Fe-56 Cu-64 Zn-65 Ag-108
第Ⅰ卷(选择题共24分)
选择题(每小题3分,共24分)在每小题给出的四个选项中,只有一项是符合题目要求的。
1、下列图示的实验中,正确的是( )
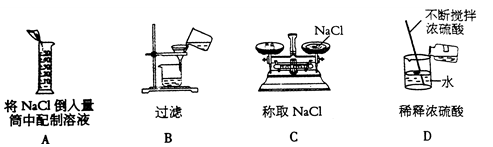
2、化学与生活、生产、科技密不可分,下列叙述正确的是( )
A、合金、塑料、玻璃钢属于合成材料 B、用甲醛浸泡过的水产品,可放心食用
C、研制新材料、新能源替代传统能源,减少污染 D、化肥硝酸铵可与碱性物质混合使用,增大肥效
3、最近,“镉大米”成为公众关注的热点问题之一。据了解,含镉的大米对人的肝肾损害比较大。镉(Cd)的原子序数为48,中子数为64,下列说法错误的是( )
A、镉原子的质子数为48 B、镉原子的相对原子质量为112g
C、镉是金属元素 D、镉原子的核外电子数为48
第Ⅱ卷(非选择题共51分)
二 、填空题(本题7个小题,共27分)
9、(4分)从C、H、N、Cl、Fe五种元素中,选择适当元素符号按要求填空。
⑴用适当的符号和数字填空。①2个氮气分子 ②氯化亚铁中的阳离子 。
⑵写出符合下列要求的物质的化学式。①最简单的有机物 ②含氯元素的氮肥
10、(4分)加强对空气质量的监测是保护环境的一项重要措施,下表是达州市一年四季空气质量监测的平均数据。请你据表回答下列问题。
|
|
可吸入颗粒物(TSP) |
氮氧化合物(NO2等) |
二氧化硫(SO2) |
空气质量级别 |
|
春季 |
88 |
40 |
44 |
Ⅱ |
|
夏季 |
67 |
33 |
36 |
Ⅱ |
|
秋季 |
90 |
46 |
54 |
Ⅱ |
|
冬季 |
98 |
69 |
60 |
Ⅱ |
⑴对我市空气质量影响最大的指标是 。
⑵空气质量最差的季节是 。
⑶你认为造成这种情况的原因是 。(答一点即可)
⑷可采取的有效防治措施是 。(答一点即可)
11、(3分)下列是明朝诗人于谦的《石灰吟》: ①千锤万凿出深山,②烈火焚烧若等闲,
③粉身碎骨浑不怕,④要留清白在人间。
⑴诗中隐含物理变化的诗句是 。(填序号)
⑵请写出诗中所涉及的化学方程式 。
12、(2分)2.3g某物质在空气中完全燃烧,生成4.4g二氧化碳和2.7g水,则该物质中一定含有 元素(填元素符号),其质量比为 。
13、(3分)A、B两物质的溶解度曲线如图所示,请根据曲线回答下列问题:
⑴t1℃时,A的饱和溶液中溶质与溶液质量比 ;
⑵若B中含有少量A,应用 法提纯B;
⑶若将A的饱和溶液从t2℃降温到t1℃时,一定不会发生改变的是 。
A.溶解度 B.溶剂质量 C.溶质质量 D.溶质质量分数
14、(5分)有一包白色粉末,可能含有Ba(OH)2、KNO3、FeCl3、Na2CO3、Na2SO4中的一种或几种。为了确定其成分,进行如下实验:
①取一定量的白色粉末加入足量的水,振荡,静置,得白色沉淀,上层清液为无色。
②过滤,在白色沉淀中加入足量稀盐酸,白色沉淀全部溶解,且有气泡产生。
⑴据此推断,该白色粉末中一定含有 ;可能含有 ;一定不含有 。
⑵写出步骤②中发生反应的的化学方程式: 。
15、(6分)实验室要制取一瓶纯净、干燥的二氧化碳气体,请根据以下装置回答下列问题。
⑴发生装置应选 (填写装置的字母代号)。
⑵用F装置而不用E装置收集二氧化碳的原因是 。
⑶若用G装置来收集二氧化碳,气体应从 端进入(填a或b)。
⑷若要用C装置来干燥二氧化碳,C装置中应盛放的物质是 。
⑸D装置通常用来除去二氧化碳中混有的少量氯化氢气体,请写出化学方程式
。
三、实验探究题(本题2个小题,共16分)
16、(8分)日常生活中使用的塑料袋,有的是用聚乙烯制成的,有的是用聚氯乙烯制成的。小凤对包装食品的塑料袋进行探究,以验证其成分。
【作出猜想】:①该塑料袋是用聚乙烯制成的 ②该塑料袋是用聚氯乙烯制成的;
【查阅资料】:聚乙烯燃烧生成二氧化碳和水;聚氯乙烯燃烧生成二氧化碳、水和氯化氢;无水硫酸铜是白色粉末,遇水变为蓝色。
【实验探究】:小凤将装置按A、B、C、D顺序连接好后,进行实验。在实验过程中,B、D产生明显现象,C无明显现象,说明塑料袋没有 气体生成(填化学式)。B装置的作用是 ;D瓶中发生反应的化学方程式是 。
【实验结论】:通过实验证明,猜想 是正确的。
【交流反思】:①从化学角度分析,大量使用塑料制品会导致 。
②连接实验仪器时,能否 (填“能"或“不能”)将B、C位置进行交换,理由是
17.(8分)同学们在学习Ca(OH)2的化学性质时,对Ca(OH)2溶液和Na2CO3溶液反应后溶液中溶质的成分进行探究。请你一同探究并回答下列问题:
【提出问题】:滤液中的溶质是什么物质?溶液呈中性。
【查阅资料】:①Ca(NO3)2溶液呈中性。 ②Ca(NO3)2 +Na2CO3= CaCO3↓+2NaNO3
【猜想假设】:甲同学认为:只含有NaOH; 乙同学认为:只含有NaOH Ca(OH)2;
丙同学认为:含有NaOH Ca(OH)2 Na2CO3; 你认为可能含有 。
【分析讨论】:丁同学认为 同学的猜想肯定是不合理的,理由是 。
【实验设计】:请你设计一个简单的实验来验证你的猜想是正确的。
|
实验步骤 |
实验现象 |
实验结论 |
|
取滤液于试管中
|
|
猜想正确 |
甲同学也针对自己的猜想进行了如下实验。
|
实验步骤 |
实验现象 |
实验结论 |
|
取滤液于试管中滴加少量的稀盐酸 |
无明显现象 |
猜想正确 |
你认为甲同学的实验结论是否正确 (填正确或不正确),理由是 。
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑
。
四、计算题(本题1个小题,共8分)
18、(8分)现有含HCl和CuCl2的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量关系如图所示。
⑴当加入NaOH溶液质量为ag时,溶液中的溶质有 ;
⑵求混合溶液中CuCl2的质量分数。
⑶求恰好完全反应时,消耗NaOH溶液的总质量。